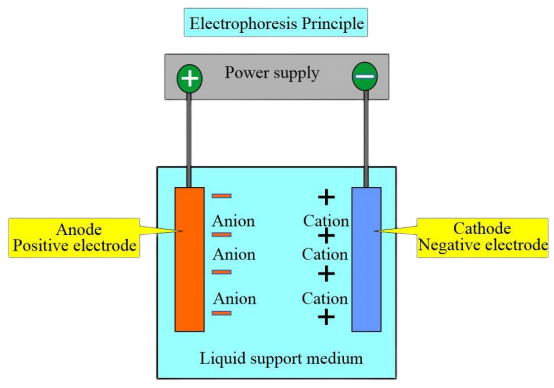
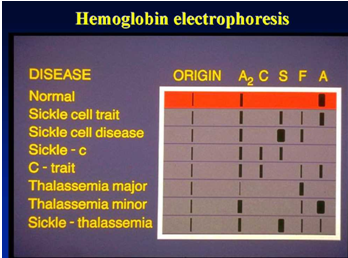
Principio dell'esperimento
L'elettroforesi dell'emoglobina mira a rilevare e confermare varie emoglobine normali e anormali.
A causa delle diverse cariche e dei punti isoelettrici dei diversi tipi di emoglobina, in una determinata soluzione tampone a pH, quando il punto isoelettrico dell'emoglobina è inferiore al pH della soluzione tampone, l'emoglobina trasporta una carica negativa e migra verso l'anodo durante l'elettroforesi. Al contrario, l'emoglobina con carica positiva si muove verso il catodo.
Sotto un certo voltaggio e dopo uno specifico tempo di elettroforesi, le emoglobine con cariche e pesi molecolari diversi mostrano direzioni e velocità di migrazione diverse. Ciò consente la separazione di zone distinte e la successiva analisi colorimetrica o di scansione elettroforetica può essere eseguita su queste zone per quantificare varie emoglobine. Il metodo più comunemente utilizzato è l’elettroforesi su membrana di acetato di cellulosa a pH 8,6.
All'interno del citoplasma, i gruppi del glicole etilenico (CHOH-CHOH) presenti nel glicogeno o nelle sostanze polisaccaridiche (come mucopolisaccaridi, mucoproteine, glicoproteine, glicolipidi, ecc.) vengono ossidati dall'acido periodico e convertiti in gruppi aldeidici (CHO-CHO). Questi gruppi aldeidici si combinano con il reagente di Schiff incolore rosso porpora, formando un colorante rosso porpora che si deposita dove sono presenti i polisaccaridi nella cellula. Questa reazione è nota come colorazione con acido periodico di Schiff (PAS), precedentemente denominata colorazione del glicogeno.
Metodo dell'esperimento
Materiali:Acetato di cellulosamembrana, apparecchio per elettroforesi(DYCP-38C e alimentatore DYY-6C), Strumento di caricamento dei campioni superiore (pipetta), spettrofotometro, cuvette colorimetriche, buffer.
Respingente:
(1) Tampone TEB pH 8,6: pesare 10,29 g di Tris, 0,6 g di EDTA, 3,2 g di acido borico e aggiungere acqua distillata a 1.000 ml.
(2) Tampone borato: pesare 6,87 g di borace e 5,56 g di acido borico e aggiungere acqua distillata a 1.000 ml.
Procedura:
Priparazione della soluzione di emoglobina
Prendi 3 ml di sangue contenente eparina o citrato di sodio come anticoagulante. Centrifugare a 2000 giri/min per 10 minuti ed eliminare il plasma. Lavare i globuli rossi tre volte con soluzione fisiologica (750 giri/min, centrifugazione di 5 minuti ogni volta). Centrifugare a 2200 giri per 10 minuti ed eliminare il surnatante. Aggiungere una quantità uguale di acqua distillata, quindi aggiungere 0,5 volte il volume di tetracloruro di carbonio. Agitare vigorosamente per 5 minuti, quindi centrifugare a 2200 giri/min per 10 minuti per raccogliere la soluzione di Hb superiore per un uso successivo.
Immergere la membrana
Tagliare la membrana di acetato di cellulosa in strisce di 3 cm × 8 cm. Immergerli nel tampone TEB a pH 8,6 fino a completa saturazione, quindi rimuoverli e asciugarli con carta da filtro.
Avvistamento
Utilizzare una pipetta per posizionare 10 μl della soluzione di emoglobina verticalmente sulla membrana di acetato di cellulosa (il lato ruvido), a circa 1,5 cm dal bordo.
Elettroforesi
Versare la soluzione tampone borato nella camera dell'elettroforesi. Posizionare la membrana di acetato di cellulosa con il lato macchiato all'estremità catodica della camera. Eseguire a 200 V per 30 minuti.
Eluizione
Ritagliare le zone HbA e HbA2, metterle in provette separate e aggiungere rispettivamente 15 ml e 3 ml di acqua distillata. Agitare delicatamente per eluire completamente l'emoglobina, quindi mescolare.
Colorimetria
Azzerare l'assorbanza utilizzando acqua distillata per la soluzione di eluizione e misurare l'assorbanza a 415 nm.
Calcolo
HbA2(%) = Assorbanza della provetta di HbA2 / (Assorbanza della provetta di HbA2 × 5 + Assorbanza della provetta di HbA2) × 100%
Calcolo dei risultati sperimentali
Intervallo di riferimento per l'elettroforesi dell'acetato di cellulosa tampone TEB a pH 8,6: HbA > 95%, HbA2 1%-3,1%
Note
Il tempo dell'elettroforesi non dovrebbe essere troppo lungo. La membrana di acetato di cellulosa non deve seccarsi durante l'elettroforesi. Interrompere l'elettroforesi quando HbA e HbA2 sono chiaramente separati. L'elettroforesi prolungata può causare diffusione e sfocatura della banda.
Evitare di utilizzare una quantità eccessiva di campione. Un eccesso di emoglobina liquida può portare al distacco della banda o a una colorazione insufficiente, con conseguenti livelli di HbA1c falsamente elevati.
Prevenire la contaminazione della membrana di acetato di cellulosa con proteine.
La corrente non dovrebbe essere troppo elevata; in caso contrario, le bande di emoglobina potrebbero non separarsi.
Includere sempre campioni di individui normali e le necessarie emoglobine anomale note come controlli.
Beijing Liuyi Biotechnology produce il serbatoio di elettroforesi professionale per l'elettroforesi dell'emoglobina che è il modelloDYCP-38Cserbatoio per elettroforesi con membrana di acetato di cellulosa e sono disponibili due modelli di alimentatore per elettroforesi per il serbatoio di elettroforesi con membrana di acetato di cellulosaDYY-2CEDYY-6CAlimentazione elettrica.
Nel frattempo, Beijing Liuyi Biotechnology fornisce ai clienti membrane di acetato di cellulosa e le dimensioni della membrana di acetato di cellulosa possono essere personalizzate. Benvenuti a chiederci campioni e ulteriori informazioni.
Il marchio Beijing Liuyi ha più di 50 anni di storia in Cina e l'azienda è in grado di fornire prodotti stabili e di alta qualità in tutto il mondo. Attraverso anni di sviluppo, è degno della tua scelta!
Stiamo ora cercando partner, sia i serbatoi per elettroforesi OEM che i distributori sono i benvenuti.
Se hai un piano di acquisto per i nostri prodotti, non esitare a contattarci. Puoi inviarci un messaggio via e-mail[e-mail protetta]O[e-mail protetta], oppure chiamaci al +86 15810650221 o aggiungi Whatsapp +86 15810650221, o Wechat: 15810650221
Orario di pubblicazione: 20 settembre 2023